当一位糖尿病患者因双脚持续灼烧感夜不能寐,或一位化疗患者因肢体刺痛而无法正常生活时,他们可能正经历着神经病理性疼痛(NP)。这种由神经系统损伤引发的慢性疼痛,全球患病率高达7%-10%,且常规镇痛药对其效果有限。本文将从发病机制、诊断方法到前沿治疗策略展开解析,为患者提供科学认知与实用建议。
一、神经病理性疼痛的临床特征与诊断挑战
NP的典型症状包括自发性刺痛、烧灼感,或由轻微触碰引发的剧烈疼痛(触诱发痛)。例如,带状疱疹后神经痛患者常皮肤区域存在“电流穿透感”,而糖尿病周围神经病变者可能出现“赤足踩玻璃”般的足底疼痛。
诊断需结合临床症状量表(如DN4量表)和神经功能检测。DN4量表通过10项症状评估,若得分≥4分即可初步判断为NP。值得注意的是,儿童患者可能表现为异常哭闹或回避触摸,孕妇群体则需警惕药物对胎儿的影响。
二、疼痛背后的科学机制:从分子到系统
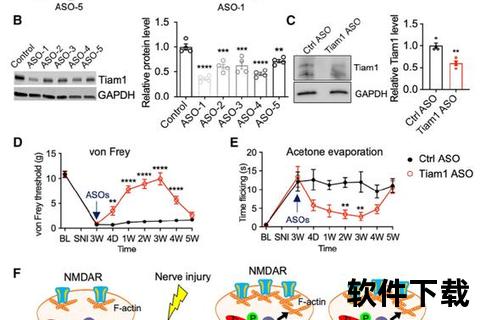
NP的核心机制涉及外周与中枢神经系统的协同异常(图1)。
1. 外周敏化:神经损伤导致TRPV4离子通道过度激活,促使脊髓小胶质细胞释放促炎因子LCN2,放大疼痛信号。
2. 中枢敏化:脊髓背角神经元中,5-HT2C受体异常活化会解除对痛觉通路的抑制,形成“疼痛记忆”。
3. 表观遗传调控:RNA修饰(如ac4C)通过增强VEGFA蛋白翻译效率,加剧脊髓神经元兴奋性。DNA甲基化与组蛋白乙酰化失衡也被证实与慢性疼痛相关。
三、传统治疗的局限性
目前一线药物如加巴喷丁(靶向钙通道α2δ亚基)和三环类抗抑郁药,仅对30%-50%患者有效,且存在嗜睡、口干等副作用。类药物因成瘾风险已被多国指南列为二线选择。
四、靶向治疗新策略:从实验室到临床
1. 精准阻断离子通道
2. 调控神经免疫交互
靶向线粒体的TPP-Au-Ru纳米酶通过清除活性氧(ROS)和抑制NF-κB通路,在小鼠模型中单次给药即可缓解疼痛36小时,且能穿透血脑屏障。
3. 表观遗传干预
针对RNA修饰酶NAT10的抑制剂,在动物实验中使VEGFA表达降低70%,显著改善触诱发痛。组蛋白去乙酰化酶(HDAC)抑制剂也进入Ⅱ期临床试验阶段。
4. 新型药物递送系统
苯磺酸美洛加巴林作为新一代α2δ配体,通过缓释技术维持稳定血药浓度,较传统药物减少30%头晕发生率。
五、患者管理实用建议
1. 居家护理:
2. 就医指征:若出现肢体无力、大小便失禁或疼痛影响睡眠超2周,需立即神经专科就诊。
3. 特殊人群注意:孕妇应避免使用加巴喷丁(致畸风险C级),可考虑低剂量阿米替林。
六、未来方向:个体化医疗与联合治疗
基因检测指导的药物代谢分型(如CYP450酶多态性)已在临床试验中应用,使治疗有效率提升至65%。联合用药方案(如纳米酶+离子通道抑制剂)在动物模型中展现协同效应,疼痛缓解率提高40%。
神经病理性疼痛的治疗正从“对症镇痛”迈向“机制修复”的新纪元。患者需认识到,疼痛管理是动态调整的过程,及时沟通症状变化与医生共同制定方案,方能重获生活质量。随着靶向药物与智能递送系统的突破,未来十年或将迎来NP治疗的“精准治愈时代”。