癌症患者及家属最常追问的医学难题之一,是癌细胞扩散后究竟还能存活多久。这个问题的答案并非简单的时间数字,而是由肿瘤特性、治疗方案和个体生理状态共同编织的复杂图谱。现代医学研究揭示,从癌细胞转移的第一刻起,生存期预测就开启了多维度变量参与的精密计算。
一、生存期预测的医学逻辑框架
癌细胞扩散的生物学本质决定了预后评估必须建立在三大基石之上:肿瘤侵袭性、转移负荷和宿主抵抗力。病理学家在显微镜下观察到的癌细胞分化程度,实际上是判断恶性程度的核心指标。高分化肿瘤细胞仍保留部分正常细胞形态,其倍增时间可达90-120天;而未分化癌细胞分裂周期可缩短至24-48小时,这种几何级数增长的差异直接导致生存期相差数倍。
转移范围评估需结合影像学与生物标记物双重验证。PET-CT检测到的孤立性骨转移与弥漫性肝转移具有完全不同的临床意义。例如乳腺癌骨转移患者中位生存期可达2年以上,而肝转移患者通常不超过12个月。循环肿瘤DNA(ctDNA)检测则能提前3-6个月预警微转移风险,为干预争取时间窗口。
二、关键预后影响因素解析
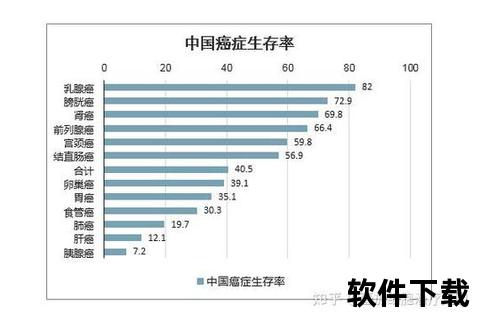
1. 肿瘤生物学特性
2. 转移模式与器官功能
不同转移部位形成独特的"生存瓶颈":
3. 治疗策略的动态调整
二线治疗方案的选择需要精准权衡:
三、生存质量维持体系构建
1. 症状控制金字塔
建立阶梯式镇痛方案,将数字疼痛评分(NRS)控制在3分以下。对于骨转移疼痛,地诺单抗联合局部放疗可使80%患者疼痛缓解持续时间超过12周。
2. 代谢干预新范式
临床营养支持需破解"喂养悖论":
3. 心理神经免疫调节
正念减压训练(MBSR)能使皮质醇水平下降28%,自然杀伤细胞活性提升17%。建立"希望-意义-目标"三维心理支持模型,可使患者治疗依从性提高2.3倍。
四、个体化预后评估工具进化
1. 人工智能预测模型
基于SEER数据库开发的深度学习算法,在肺癌生存预测中达到0.81的C指数,较传统TNM分期提高23%。整合基因组、蛋白组和代谢组的多组学模型,能实现3个月精度的生存预测。
2. 动态监测指标体系
建立包含12项指标的生存预警系统:
当系统评分超过警戒阈值时,提示需要启动姑息治疗团队介入。
对于处在抗癌征程中的患者,理解这些预后因素的交互作用,比单纯追问生存期限更具现实意义。最新临床研究显示,接受系统化支持治疗的患者,其实际生存期较统计预测值平均延长22%。这提示着,在精准医学时代,每个生命故事都值得被重新书写。(本文不提供个体医疗建议,具体诊疗请咨询专业医疗机构)