宫颈上皮内瘤变(CIN)是女性宫颈癌发生前的关键阶段,早期发现与干预能有效阻断癌症进展。这种病变与高危型人瘤病毒(HPV)持续感染密切相关,但多数人对它的认知仍停留在“癌前病变”的模糊概念中。本文将系统解析CIN的病因机制、分级标准及诊疗策略,帮助公众科学认识这一疾病。
一、CIN的病因与发生机制
CIN的核心病因是高危型HPV持续感染(如HPV16、18型)。HPV病毒通过性接触传播,感染宫颈上皮细胞后,其致癌蛋白E7会干扰细胞周期调控,导致抑癌基因p16INK4a过度表达,细胞异常增殖。以下因素可能加速病变进展:
研究表明,HPV感染后约需8-12年发展为宫颈癌,而CIN2-3患者若未治疗,进展为浸润癌的风险高达5%-30%。
二、CIN的分级标准与临床意义
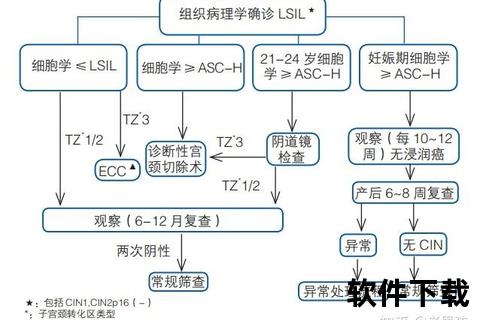
CIN根据细胞异型程度分为三级,这一分级直接影响治疗决策(图1):
1. CIN1(轻度异型增生)
病变局限于上皮下1/3,细胞轻度异常,60%可自然消退,仅需观察或药物治疗。
2. CIN2(中度异型增生)
异常细胞累及下2/3层,癌变风险约20%。需结合患者年龄、生育需求选择物理治疗或手术。
3. CIN3(重度异型增生/原位癌)
全层上皮细胞严重异常,癌变率超过40%。推荐宫颈锥切术等根治性治疗。
> 临床案例:49岁赵女士HPV58阳性合并CIN2-3,接受全子宫切除后病理未提示癌变,定期随访即可。这提示及时治疗高级别病变可有效阻断癌症发展。
三、诊断流程:精准筛查是关键
CIN诊断遵循“三阶梯”原则:
1. 初筛:HPV检测联合宫颈细胞学检查(TCT),检出率高达95%;
2. 分流:镜检查可疑区域,醋酸试验识别病变边界;
3. 确诊:活检病理检查,必要时联合p16免疫组化检测提高准确性。
值得注意的是,p16INK4a蛋白检测可将诊断一致性从56.6%提升至74.9%,尤其适用于鉴别CIN2与反应性增生。
四、治疗策略:个体化选择
治疗方案需综合病变级别、生育需求及医疗资源(表1):
| 分级 | 治疗建议 | 依据来源 |
|--|--||
| CIN1 | 观察随访(6-12个月复查),必要时局部用药(干扰素、保妇康栓) | |
| CIN2 | 未育女性:冷冻/激光治疗;已育或病变广泛:LEEP术 | |
| CIN3 | 宫颈锥切术(冷刀或LEEP),切缘阳性者需二次手术或子宫切除 | |
特殊人群注意事项:
> 患者故事:30岁未育女性确诊CIN2,通过中药调理联合局部治疗100天后转阴。这提示低级别病变在规范管理下存在逆转可能。
五、预防与管理:三级防线构筑健康
1. 一级预防:接种HPV疫苗,九价疫苗可预防90%宫颈癌;
2. 二级预防:21岁后定期筛查(TCT+HPV),30岁以上每3-5年复查;
3. 三级预防:治疗后每3-6个月随访,监测HPV转阴及病变复发。
生活方式干预:、规律作息、安全性行为可降低复发风险。
CIN的防治需要医患共同参与。普通女性无需对HPV阳性过度恐慌——80%感染可在2年内自行清除。关键在于建立科学认知:定期筛查能早期发现病变,规范治疗可有效阻断癌症进程。若出现接触性出血、异常分泌物等症状,应及时就医评估。健康的生活方式与积极的随访管理,是守护宫颈健康的核心防线。